สเปิร์ม (SPERM) : โครงสร้างและความสามารถในการเจริญพันธุ์ (Structure and ItsReproductive Capacity) จัดทำขึ้นเพื่อรวบรวมข้อมูลองค์ความรู้ ทั้งส่วนที่เป็นความรู้พื้นฐานทั่วไปในโครงสร้างของสเปิร์ม และความสามารถในการเจริญพันธุ์ในภาวะปกติ และในส่วนที่เป็นองค์ความรู้และความก้าวหน้าทางเทคโนโลยีที่เกี่ยวข้องกับสเปิร์ม ทั้งในส่วนที่เป็นสภาพปัญหาอันนำไปสู่ภาวะการมีบุตรยากในเพศชาย อันมีสาเหตุมาจากความผิดปกติในโครงสร้างและความสามารถในการเจริญพันธุ์ของสเปิร์ม และการใช้สเปิร์มในเทคโนโลยีช่วยการเจริญพันธุ์ (Assisted Reproduction Technology;ART) ในรูปแบบต่างๆ เพื่อช่วยแก้ปัญหาภาวะการมีบุตรยากในคนที่มีอยู่ในปัจจุบัน

นอกจากนี้ในหนังสือเล่มนี้ยังเป็นการรวบรวมผลงานวิจัยของผู้แต่งและคณะผู้ร่วมวิจัย ที่ได้ทำการศึกษาความเป็นพิษของสารเสพติดชนิดต่าง ๆ ที่มีผลต่อกระบวนการสร้างสเปิร์มและคุณภาพของสเปิร์ม ทำให้ได้ข้อมูลที่เป็นประโยชน์อย่างยิ่งในการช่วยวินิจฉัย หรือกำหนดแนวทางการแก้ไข หรือป้องกันความบกพร่องในความสามารถของสเปิร์มในการเจริญพันธุ์ในคนกลุ่มเสี่ยงที่มีการใช้สารเสพติดดังกล่าว และเป็นข้อมูลที่สะท้อนผลร้ายของการใช้สารเสพติด หรือการได้รับยาที่มีส่วนผสมของสารเสพติดชนิดต่างๆ อย่างต่อเนื่องที่อาจส่งผลต่อความสามารถในการเจริญพันธุ์ นอกเหนือจากผลกระทบที่มีต่อระบบประสาทที่ทราบกันเป็นอย่างดีอยู่แล้ว
บทที่ 1 อวัยวะสืบพันธุ์เพศชาย (Male Reproductive Organs)
อวัยวะสืบพันธุ์เพศชาย (Male reproductive organs) อวัยวะสืบพันธุ์เพศชาย ประกอบด้วยโครงสร้างหลัก ดังต่อไปนี้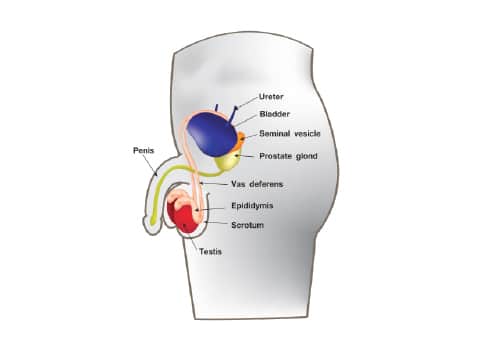
– อัณฑะ (Testis)
– ถุงอัณฑะ (Scrotum)
– ท่อพักอสุจิ (Epididymis)
– หลอดน้ำอสุจิ (Vas deferens)
– ท่อฉีดอสุจิ (Ejaculatory duct)
– ต่อมสร้างน้ำเลี้ยงอสุจิ (Seminal vesicle)
– ต่อมลูกหมาก (Prostate gland)
– ต่อมคาวเปอร์ (Cowper’s gland)
– องคชาต (Penis)
บทที่ 2 กระบวนการสร้างสเปิร์ม (Spermatogenesis)
กระบวนการสร้างสเปิร์ม (Spermatogenesis) เกิดขึ้นภายในท่อสร้างสเปิร์ม (Seminiferoustubule) ที่อยู่ภายในอัณฑะ (Testis) (รูปที่ 2) เป็นการสร้างสเปิร์มจากเซลล์เริ่มต้น ที่เรียกว่าSpermatogonia ที่มีจำนวนโครโมโซม 2N และจะมีการแบ่งเซลล์ในขั้นตอนต่างๆ จนในที่สุดได้เซลล์สเปิร์ม(Sperm หรือ Spermatozoa) จำนวน 4 เซลล์ ที่มีจำนวนโครโมโซมลดลงครึ่งหนึ่ง (1N)
กระบวนการสร้างสเปิร์มเป็นกระบวนการที่อาศัยการควบคุมที่เหมาะสม โดยเฉพาะอย่างยิ่งการควบคุมผ่านกระบวนการ DNA methylation และ Histone modification โดยกระบวนการสร้างสเปิร์มจะเริ่มต้นเมื่อผู้ชายเข้าสู่วัยรุ่น (Puberty) และจะสร้างอย่างต่อเนื่องไปเรื่อย ๆ ทั้งนี้อัตราการสร้างสเปิร์มจะลดลงตามอายุที่เพิ่มขึ้น กระบวนการสร้างสเปิร์มในมนุษย์จะมีการสร้างสเปิร์มได้เฉลี่ยประมาณ200 ถึง 300 ล้านเซลล์ต่อวัน โดยใช้เวลาตลอดกระบวนการประมาณ 74 วันภายในอัณฑะ และใช้เวลาในการเคลื่อนที่ไปยังตำแหน่งที่จะเกิดการปฏิสนธิกับเซลล์ไข่อีกประมาณ 3 เดือน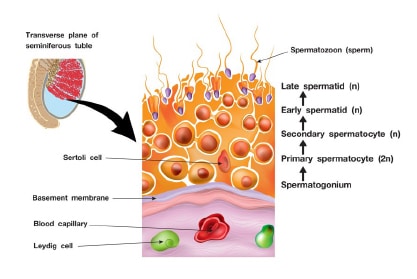
บทที่ 3 สเปิร์มกับการปฏิสนธิ (Sperm and Fertilization)
ลักษณะทางกายวิภาคของสเปิร์ม (Sperm anatomy)
สเปิร์มประกอบไปด้วยโครงสร้าง 3 ส่วน ดังนี้ (รูปที่ 3)
1. ส่วนหัว (Head) เป็นส่วนที่ประกอบไปด้วยนิวเคลียส (Nucleus) ซึ่งมีลักษณะเป็น Haploidnucleus (1N) มีส่วนที่คลุมทางด้านหน้าของส่วนหัวของสเปิร์มด้วยโครงสร้างที่เรียกว่า Acrosome ที่มีลักษณะเป็นผนังชั้นเดียว (Single membrane sac) ภายในบรรจุเอ็นไซม์ที่สำคัญต่อกระบวนการปฏิสนธิ และมีโครงสร้างที่เรียกว่า Centriole 1 คู่ วางตัวอยู่ทางด้านหลังต่อนิวเคลียส ซึ่งจะพัฒนาไปเป็นส่วนหาง (Tail) ของสเปิร์มต่อไป
2. ส่วนกลาง (Midpiece) เป็นส่วนที่ประกอบด้วย Mitochondria เป็นส่วนใหญ่ วางตัวเป็นเกลียวตลอดความยาวของส่วน Midpiece ทำหน้าที่สร้างพลังงาน (ATP) เพื่อใช้ในการเคลื่อนที่ของสเปิร์ม
3. ส่วนหาง (Tail) ประกอบด้วยโครงสร้างที่เรียกว่า Flagellum ซึ่งประกอบไปด้วย Axoneme หรือ Microtubules เพื่อทำหน้าที่ในการเคลื่อนที่ของสเปิร์ม
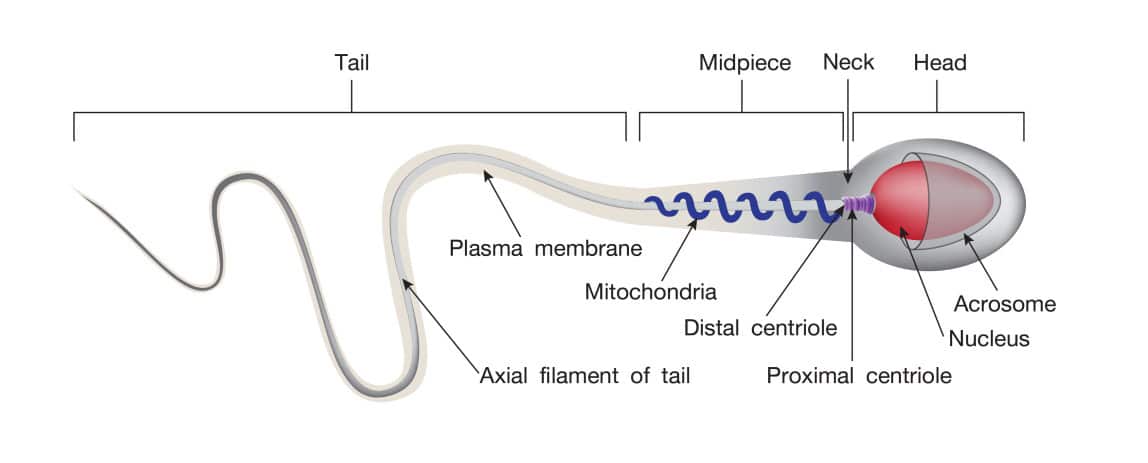
รูปที่ 3 แสดงโครงสร้างทางกายวิภาคของสเปิร์ม (Sperm anatomy)

บทที่ 4 การตรวจวิเคราะห์น้ำอสุจิ (Semen Analysis)
การหลั่งน้ำอสุจิ (Ejaculation) เป็นการหลั่งให้น้ำอสุจิ (Semen) ออกจากทางเดินระบบสืบพันธุ์เพศชาย ซึ่งจะเกิดขึ้นในขณะที่ฝ่ายชายเข้าสู่ภาวะถึงจุดสุดยอด (Orgasm) บางกรณีอาจเกิดขึ้นโดยไม่รู้ตัวในขณะที่นอนหลับ หรือที่นิยมเรียกกันว่า ฝันเปียก (Wet dream) ในบางกรณีการหลั่งน้ำอสุจิอาจมีความผิดปกติ อันเนื่องมาจากจากความผิดปกติที่เกิดขึ้นในต่อมลูกหมาก (Prostatic disease)หรือบางกรณีฝ่ายชายอาจจะไม่สามารถหลั่งน้ำอสุจิได้เลย จะเรียกภาวะนี้ว่า Anejaculation ส่วนกรณีที่มีการหลั่งน้ำอสุจิได้ แต่ไม่คล่องตัว หรือมีความเจ็บปวดร่วมขณะหลั่งน้ำอสุจิ เรียกภาวะนี้ว่า Dys-ejaculation
บทที่ 5 การได้มาของสเปิร์มเพื่อใช้ในเทคโนโลยีช่วยการเจริญพันธุ์ (Sperm Retrieval for ART)
ภาวะการมีบุตรยาก (Infertility)
ภาวะการมีบุตรยาก (Infertility) หมายถึง การที่คู่สมรสที่ฝ่ายหญิงมีอายุต่ำกว่า 35 ปี ไม่สามารถมีบุตรได้หลังจากการมีเพศสัมพันธ์กับฝ่ายชายอย่างสมำเสมอโดยไม่ได้คุมกำเนิดเป็นเวลาอย่างน้อย12 เดือน หรือในกรณีที่คู่สมรสที่ฝ่ายหญิงอายุตั้งแต่ 35 ปีขึ้นไปไม่สามารถมีบุตรได้ ภายในเวลา 6 เดือนภายหลังจากการมีเพศสัมพันธ์กับฝ่ายชายอย่างสม่ำเสมอโดยไม่ได้คุมกำเนิดเช่นกัน [1] ทั้งนี้โดยปกติคู่สมรสที่มีเพศสัมพันธ์โดยไม่ได้คุมกำเนิด จะมีโอกาสตั้งครรภ์ประมาณร้อยละ 85 ภายในระยะเวลา 12 เดือน [2]
สาเหตุของภาวะการมีบุตรยาก สามารถจำแนกที่มาของสาเหตุ ได้ดังนี้ [8]
– มีสาเหตุมาจากเพศชายประมาณร้อยละ 20-30
– มีสาเหตุจากเพศหญิงประมาณร้อยละ 40-55
– มีสาเหตุจากทั้งเพศชายและหญิงร่วมกันประมาณร้อยละ 20-30
– ไม่ทราบสาเหตุอีกประมาณร้อยละ 10-20
บทที่ 6 สเปิร์มกับเทคโนโลยีช่วยการเจริญพันธุ์: การฉีดน้ำอสุจิเข้าสู่โพรงมดลูกโดยตรง (Intrauterine Insemination; IUI)
Intrauterine insemination (IUI) หรือการฉีดน้ำอสุจิเข้าสู่โพรงมดลูกโดยตรง (รูปที่ 31)เป็นการนำน้ำอสุจิที่ได้รับการคัดแยกแล้วมาฉีดเข้าไปในโพรงมดลูกในช่วงเวลาที่มีการตกไข่ เพื่อให้ตัวสเปิร์มว่ายจากโพรงมดลูกไปตามท่อน้ำไข่และปฏิสนธิกับเซลล์ไข่ด้วยตัวเองต่อไป วิธีนี้จะใกล้เคียงกับการปฏิสนธิโดยธรรมชาติมากที่สุด อย่างไรก็ตามเพื่อเพิ่มโอกาสการตั้งครรภ์ให้มากขึ้น แพทย์สามารถใช้ยากระตุ้นให้ฝ่ายหญิงมีไข่ตกมากกว่าหนึ่งใบได้ โดยแพทย์จะนัดให้มาทำการตรวจอัลตราซาวนด์เพื่อตรวจสอบขนาดของไข่เพื่อกน้ำหนดวันฉีดยากระตุ้นให้ไข่ตก และวันสำหรับฉีดน้ำอสุจิเข้าสู่โพรงมดลูกหลังจากฉีดน้ำอสุจิเข้าสู่โพรงมดลูกแล้ว โดยแพทย์จะนัดมาตรวจเพื่อตรวจสอบการตั้งครรภ์หลังจากนั้นประมาณ 12 ถึง 14 วัน [3, 4]
บทที่ 7 สเปิร์มกับเทคโนโลยีช่วยการเจริญพันธุ์: In vitro Fertilization and Embryonic Transfer (IVF-ET) หรือเด็กหลอดแก้ว
In vitro fertilization and embryonic transfer (IVF-ET) หรือเด็กหลอดแก้ว (รูปที่ 4) เป็นเทคโนโลยีที่ช่วยให้เกิดการปฏิสนธิระหว่างเซลล์ไข่และสเปิร์มภายนอกร่างกาย เป็นการแก้ปัญหาภาวะการมีบุตรยาก ด้วยการนำเซลล์ไข่ออกมาจากร่างกายของฝ่ายหญิง และนำเอาสเปิร์มของฝ่ายชายมาทำการปฏิสนธิกันภายในภาชนะบรรจุของเหลว เสร็จแล้วจึงนำเซลล์ไข่ที่มีการปฏิสนธิแล้ว หรือตัวอ่อน(Embryo) ใส่เข้าไปยังโพรงมดลูกของฝ่ายหญิงเพื่อทำให้เกิดการฝังตัวต่อไป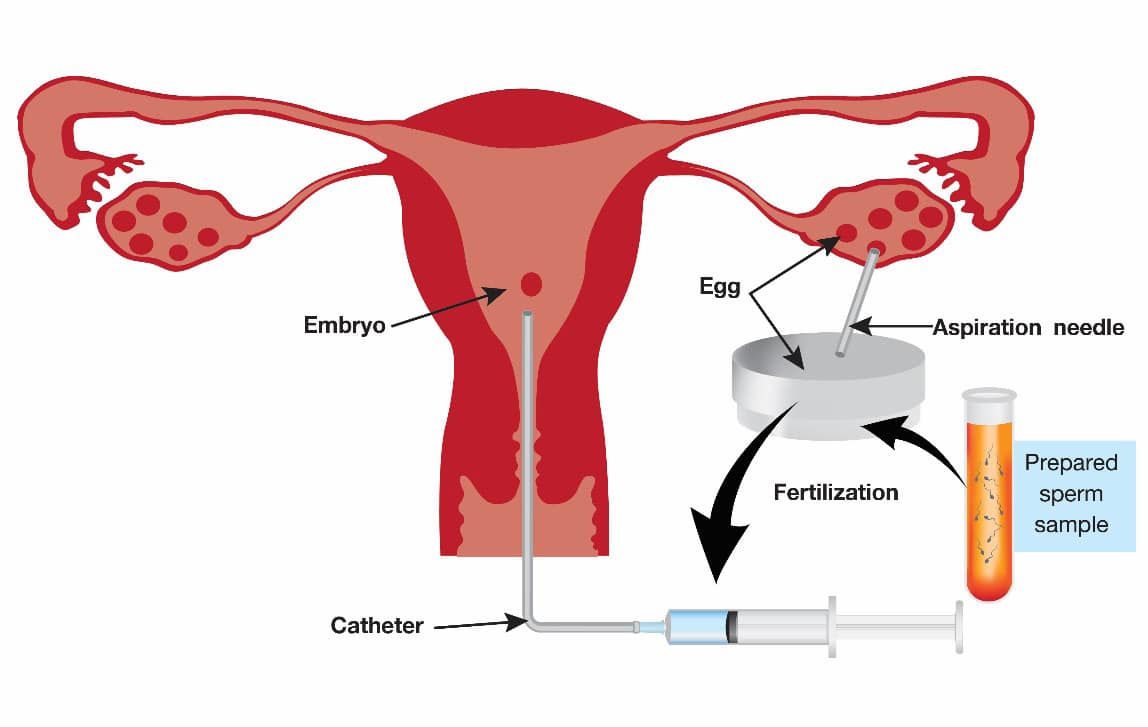
บทที่ 8 สเปิร์มกับเทคโนโลยีช่วยการเจริญพันธุ์: Gamete Intrafallopian Transfer (GIFT) และ Zygote Intrafallopian Transfer (ZIFT)
Gamete intrafallopian transfer หรือ GIFT เป็นเทคโนโลยีช่วยการเจริญพันธุ์ ซึ่งใช้วิธีการย้ายสเปิร์มและเซลล์ไข่ที่ยังไม่ได้เกิดการปฏิสนธิเข้าสู่ท่อนำไข่ โดยวิธีการทำ GIFT สำเร็จเป็นครั้งแรกในปี 1984 [5] ในการรักษาผู้มีบุตรยากซึ่งหาสาเหตุไม่พบ (Unexplained infertility) ซึ่งหลังจากนั้นวิธีการทำ GIFT ก็ได้รับความนิยมอย่างแพร่หลายในสหรัฐอเมริกา ต่อมามีพัฒนาไปใช้ Laparoscopyในการเก็บเซลล์ไข่ แต่ในช่วงแรกโอกาสสำเร็จของการทำเด็กหลอดแก้วค่อนข้างต่ำ และวิธีการยุ่งยากทำ ใหมี้สถาบนั ที่ทำเด็กหลอดแก้ว มีจำนวนไม่มากนัก ในระยะต่อ มาเมื่อ มีการพัฒนาทางเทคโนโลยีมากขึ้นโดยเฉพาะการพัฒนาวิธีการเก็บไข่ จนสามารถเก็บไข่ผ่านทางช่องคลอดภายใต้การตรวจด้วยคลื่นเสียงความถี่สูง ทำให้ขั้นตอนในการทำเด็กหลอดแก้วมีความยุ่งยากน้อยลง
บทที่ 9 สเปิร์มกับเทคโนโลยีช่วยการเจริญพันธุ์: Intra Cytoplasmic Sperm Injection (ICSI)
การทำ ICSI (Intracytoplasmic sperm injection) เป็นเทคโนโลยีช่วยการเจริญพันธุ์สำหรับผู้มีบุตรยากที่นิยมมากในปัจจุบัน โดย ICSI เป็นการคัดสเปิร์มที่มีคุณภาพดีที่สุดหนึ่งตัวมาผสมกับเซลล์ไข่ที่อยู่ในระยะที่เหมาะสมในการปฏิสนธิหนึ่งใบ โดยทำการฉีดสเปิร์มเข้าไปภายในเซลล์ไข่โดยตรง (รูปที่ 5) วิธีการนี้ทำให้อัตราการปฏิสนธิค่อนข้างสูง และช่วยลดปัญหาการปฏิสนธิแบบผิดปกติอันเนื่องมาจากเซลล์ไข่และสเปิร์มที่ผิดปกติได้ เช่น การผสมด้วยสเปิร์มหลายตัว (Polyspermy) หรือสเปิร์มไม่สามารถเจาะผ่านผนังของเซลล์ไข่ส่วน Zona pellucida (ZP) ได้ เป็นวิธีการที่พัฒนาต่อเนื่องมาจากเทคนิค Partialzona dissection (PZD) ที่มีการเจาะเปิดชั้น Zona pellucida บางส่วนเพื่อให้สเปิร์มสามารถเจาะผ่านได้ง่ายขึ้น ซึ่งก็พบข้อเสียคือทำให้เกิดภาวะปฏิสนธิซ้ำซ้อน (Polysperm) ในอัตราที่สูง และเทคนิคSubzonal insemination (SUZI) ที่ใช้การเจาะเข็มผ่าน Zona pellucida เข้าไปในบริเวณ Perivitellinespace แล้วปล่อยสเปิร์มที่บริเวณดังกล่าวเพื่อให้สเปิร์มทำการเคลื่อนที่ไปปฏิสนธิกับนิวเคลียสของเซลล์ไข่ [6] ซึ่งภายหลังจากที่มีการทำ ICSI วิธีการทั้งสองนี้ก็ไม่ได้รับความนิยมอีกต่อไป
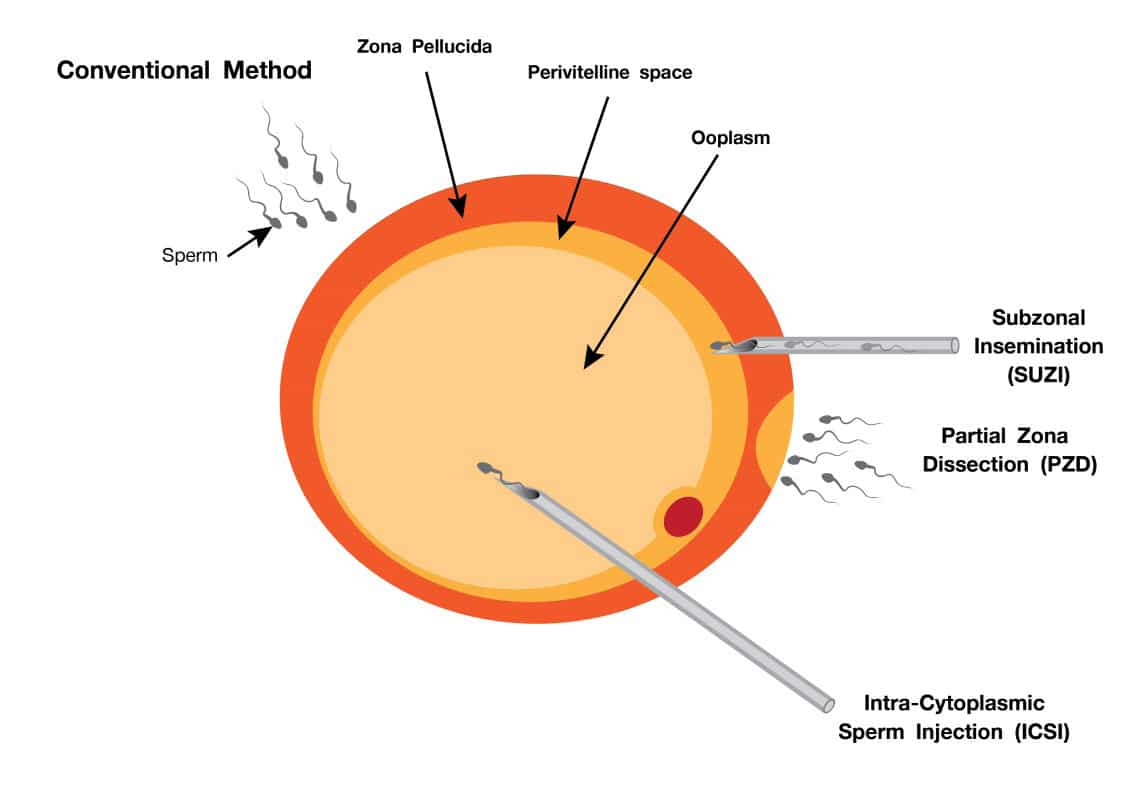
รูปที่ 5 แสดงการฉีดสเปิร์มเข้าไปในเซลล์ไข่ในกระบวนการ Intra Cytoplasmic SpermInjection หรือ ICSI เปรียบเทียบกับเทคนิค Partial zona dissection (PZD)และเทคนิค Subzonal insemination (SUZI)
บทที่ 10 การเลือกเพศบุตร
การเลือกเพศบุตร (Gender Selection)
การเลือกเพศบุตร (Gender Selection) หรือการกำหนดเพศบุตร จะมีความสำคัญมากในกรณีที่พ่อแม่ หรือบรรพบุรุษมีโรคทางพันธุกรรม ที่สามารถถ่ายทอดไปยังลูกได้ โดยการถ่ายทอดจะมีความจำเพาะต่อเพศใดเพศหนึ่ง เช่น โรคสังข์ทอง (Anhidrotic ectodermal dysplasia) โรคเลือด G6PD โรคดาวน์ซินโดรม (Down’s syndrome) โรคผิวหนังบางประเภท (Sex-linked Ichthyosis) เป็นต้นถ้าพ่อแม่หรือคนในครอบครัว เช่น ปู่ย่า ตายาย เคยมีประวัติเป็นโรคเหล่านี้มาก่อน ลูกที่คลอดออกมาที่เป็นเพศชายจะมีโอกาสเป็นโรคเหล่านี้ได้ ในขณะที่ลูกสาวจะไม่เป็น จึงเป็นเหตุสำคัญให้บางครอบครัวมีความจำเป็นต้องหลีกเลี่ยงการมีลูกชาย เป็นต้น

บทที่ 11 สารเสพติดกับความเป็นพิษต่อคุณภาพของสเปิร์ม (Addictive Substances and Toxicity to Sperm Quality)
เป็นที่ทราบกันดีว่าสารเสพติดเมทแอมเฟตามีน (Methamphetamine) หรือที่รู้จักกันโดยทั่วไปว่า “ยาบ้า” นั้น มีผลต่อระบบประสาทและทำให้การทำงานของระบบประสาทสูญเสียหากได้รับสารเสพติดนี้อย่างต่อเนื่อง อย่างไรก็ตามยังมีรายงานวิจัยที่ผ่านมาพบว่าสารเสพติดเมทแอมเฟตามีนยังมีผลต่อการเปลี่ยนแปลงทางโครงสร้างและการทำงานของระบบสืบพันธุ์ โดยเฉพาะอย่างยิ่งในเพศชายโดยมีรายงานระบุว่าเมทแอมเฟตามีนเหนี่ยวนำให้เกิดการตายของเซลล์ในรูปแบบ Apoptosis ของเซลล์ภายในท่อสร้างสเปิร์ม (Seminiferous tubule) ในหนูทดลอง [7] (Yamamoto et al., 2002) นอกจากนี้ยังพบว่าหากสัตว์ทดลองได้รับเมทแอมเฟตามีนที่ความเข้มข้นสูง จะมีผลทำให้สเปิร์มมีความสามารถในการเคลื่อนไหว (Sperm motility) ลดลง และส่งผลให้เกิดการเปลี่ยนแปลงของกระบวนการสร้างฮอร์โมนเพศชายที่ผิดปกติไป [8, 9]
จากการศึกษาวิจัยของผู้แต่งและคณะผู้วิจัย ณ คณะวิทยาศาสตร์การแพทย์ มหาวิทยาลัยนเรศวรในการศึกษาเปรียบเทียบในหนูทดลองที่ได้รับเมทแอมเฟตามีน (Methamphetamine) แบบต่อเนื่อง(Sub-chronic dose; 4 mg/kg-14 วัน) และแบบเฉียบพลัน (Acute dose; 8 mg/kg-1 ครั้ง) [10] พบว่า ความเข้มข้นของสเปิร์มลดลงอย่างมีนัยสำคัญทางสถิติในทั้ง 2 กลุ่ม เมื่อเทียบกับกลุ่มควบคุมอีกทั้งจำนวนของสเปิร์มที่มีโครงสร้างปกติ (Normal sperm morphology) จะลดลงในหนูทดลองที่ได้รับเมทแอมเฟตามีนแบบเฉียบพลัน (Acute dose) รวมทั้งพบการตายของเซลล์ภายในท่อสร้างสเปิร์มแบบ Apoptosis สูงขึ้นอย่างมีนัยสำคัญทางสถิติ ในหนูทดลองที่ได้รับเมทแอมเฟตามีนแบบเฉียบพลัน (Acute dose) เช่นกัน สะท้อนให้เห็นถึงผลของสารเสพติดชนิดเมทแอมเฟตามีนต่อกระบวนการสร้างสเปิร์มและคุณภาพของสเปิร์มได้อย่างเป็นรูปธรรมสั่งซื้อหนังสือ

ผู้เขียน

ศาสตราจารย์ ดร.เสมอ ถาน้อย
เอกสารอ้างอิง
1. Practice Committee of American Society for Reproductive Medicine.Definitions of infertility and recurrent pregnancy loss. Fertil Steril.2008; 90(5 Suppl): S60.
2. Guttmacher A.F. Factors affecting normal expectancy of conception.Journal of the American Medical Association. 1956; 161(9): 855-60.
3. โอภาส เศรษฐบุตร. การปั่นล้างสเปิร์มและฉีดเข้าไปในโพรงมดลูก (Intrauterineinsemination; IUI). สืบค้นเมื่อ 7 มกราคม 2561, จาก http://www.med.cmu.ac.th/dept/obgyn/2011/index.php?option=com_content&view=article&id=397:intrauterine-insemination&catid=40&Itemid=482
4. Martinez A.R., Bernardus R.E., Vermeiden J.P., Schoemaker J. Basic questions on intrauterine insemination: an update. Obstet Gynecol Surv. 1993; 48(12): 811-28.
5. โอภาส เศรษฐบุตร. การทำ GIFT. ใน: เทคโนโลยีช่วยการเจริญพันธุ์. เชียงใหม่:นพบุรีการพิมพ์. 2003; 103-109.
6. Tarín J.J. Subzonal insemination, partial zona dissection or intracytoplasmic sperm injection? An easy decision? Hum Reprod. 1995; 10(1): 165-70.
7. Arlas T.R., Pederzolli C.D., Terraciano P.B., Trein C.R., Bustamante-Filho I.C., Castro F.S.Sperm quality is improved feeding stallions with a rice oil supplement.Anim Reprod Sci. 2008; 107: 306.
8. Dluzen D.E., Anderson L.I., Pilati C.F. Methamphetamine–gonadal steroid hormonalinteractions: effects upon acute toxicity and striatal dopamine concentrations.Neurotoxicol Teratol. 2002; 24: 267–273.
9. Yamamoto Y., Yamamoto K., Hayase T. Effect of methamphetamine on malemice fertility. J Obstet Gynaecol Res. 1999; 25: 353–358
10. Nudmamud-Thanoi S., Thanoi S. Methamphetamine induces abnormalsperm morphology, low sperm concentration and apoptosis in the testisof male rats. Andrologia. 2011; 43(4): 278-282.



